Cos'è la celiachia? Sintomi, diagnosi, cause, complicanze e trattamenti aggiornati della malattia autoimmune legata al glutine: vaccini inversi, eTreg, farmaci biologici e molecole innovative
La celiachia è una malattia cronica caratterizzata da un’infiammazione intestinale auto-immunitaria che si verifica in individui geneticamente predisposti dopo l’ingestione di glutine. Il glutine è una proteina solubile in alcol presente nel grano, nell’orzo e nella segale. Questa proteina è abbondante negli alimenti a base di frumento come pane, pasta, pizza, biscotti e snack dolci e salati.
L’assunzione di glutine da parte di un individuo celiaco scatena una risposta immunitaria anomala nell’intestino tenue, causando un’infiammazione cronica che danneggia i tessuti intestinali e porta alla compromissione dei villi intestinali responsabili dell’assorbimento dei nutrienti. Di conseguenza, oltre al danno diretto, i pazienti possono sviluppare carenze nutrizionali a causa dell’incapacità di assorbire adeguatamente i nutrienti.

Se non diagnosticata e trattata tempestivamente, la celiachia può avere conseguenze significative e talvolta irreversibili per la salute dei pazienti
Rappresenta una patologia che interessa circa l’1% della popolazione europea; la prevalenza reale potrebbe risultare superiore a causa dell’alto numero di casi non ancora diagnosticati. Studi epidemiologici indicano che solo una quota intorno al 25% delle persone affette è stata effettivamente identificata, mentre oltre il 70% dei casi rimane sconosciuto.
In Europa, la diffusione varia tra lo 0,5% e l’1%, con alcune aree che presentano tassi più elevati. Ad esempio, in Finlandia la prevalenza tra adulti tra i 30 e i 64 anni raggiunge il 2,4%, in Germania si attesta intorno allo 0,3% e in Italia allo 0,7%. Queste differenze possono essere attribuite a molteplici fattori, tra cui il livello di consapevolezza della malattia, le modalità diagnostiche adottate e le caratteristiche genetiche delle diverse popolazioni.
La celiachia risulta spesso sottodiagnosticata, specialmente nelle sue forme atipiche o prive di sintomi evidenti. È stato osservato che solo una minima parte degli individui con anticorpi positivi manifesta danni intestinali riconoscibili, indicando così una vasta percentuale di casi non rilevati. In Italia, per esempio, si stima che solo il 15% dei casi venga diagnosticato, mentre l’85% rimane sconosciuto.
Negli ultimi decenni si è registrato un aumento significativo dell’incidenza in molte aree europee. In Scozia, ad esempio, i casi pediatrici sono aumentati di oltre sei volte tra il 1990 e il 2009, un trend attribuibile in parte a una maggiore consapevolezza e a miglioramenti nelle tecniche diagnostiche. È comunque importante considerare che questo incremento potrebbe riflettere soprattutto una più efficace identificazione dei casi, piuttosto che un vero aumento della frequenza della malattia.
La celiachia colpisce con maggiore frequenza le donne rispetto agli uomini, con un rapporto stimato di circa 2:1. Questa differenza potrebbe derivare da fattori genetici, ormonali o immunologici, sebbene le cause precise restino ancora da chiarire completamente.
La storia ha radici antiche. La malattia fu menzionata per la prima volta da Areto di Cappadocia nel 250 d.C., che descrisse i sintomi dei “coloro che soffrono negli intestini“. Nel 1856, Francis Adams tradusse il termine dal greco all’inglese, coniando il termine “celiaci”. Successivamente, nel 1888, Samuel Gee fornì una descrizione dettagliata dei sintomi negli adulti e nei bambini, anticipando che l’unico trattamento efficace sarebbe stato una dieta adeguata. Gee identificò erroneamente patate, banane e frumento come alimenti appropriati per i pazienti affetti. Solo nel 1945, il pediatra olandese Willem Karel Dicke riconobbe nella farina di frumento l’agente responsabile dei sintomi nei bambini celiaci. Dicke osservò che durante la carestia causata dalla Seconda guerra mondiale, quando il glutine veniva eliminato dalla dieta a causa della scarsità di cibo, i bambini celiaci mostravano un miglioramento significativo dei sintomi. Quando la disponibilità di cibo ritornò alla normalità, con l’arrivo di pane e pasta come aiuti alimentari, i sintomi gastro-intestinali della celiachia ricomparvero rapidamente nei bambini diagnosticati.
La celiachia può rappresentare sia una causa sia una conseguenza, diretta o indiretta, di numerose altre condizioni cliniche, attraverso meccanismi di natura immunitaria, infiammatoria e metabolica. Tra le malattie associate vi sono numerose patologie autoimmuni, quali il diabete mellito di tipo 1, la tiroidite autoimmune (come la malattia di Hashimoto e il morbo di Graves), la vitiligine, la dermatite erpetiforme e la sindrome di Sjögren. Queste associazioni si spiegano con la condivisione di fattori genetici, come gli antigeni HLA-DQ2 e DQ8, e da disfunzioni del sistema immunitario.
Può inoltre causare o aggravare disturbi gastrointestinali, quali la sindrome dell’intestino irritabile, la colite microscopica e le malattie infiammatorie croniche intestinali, a causa del danno alla mucosa intestinale e delle alterazioni della flora batterica.
Le complicanze nutrizionali derivano dal malassorbimento di nutrienti essenziali come ferro, calcio e vitamine D e B12, provocando anemia sideropenica, osteoporosi e neuropatie periferiche, con conseguenze sistemiche e aumento del rischio di fratture e problematiche neurologiche. Dal punto di vista neurologico, la celiachia è associata a manifestazioni quali atassia, neuropatia periferica, emicrania e, più raramente, epilessia, con un’origine verosimilmente autoimmune o secondaria a carenze vitaminiche. In campo riproduttivo, se non trattata può determinare infertilità, aborti ricorrenti, ritardo di crescita fetale e basso peso neonatale, presumibilmente legati a malnutrizione e infiammazione sistemica.
In rari casi, soprattutto in pazienti non adeguatamente seguiti con dieta priva di glutine, la celiachia può aumentare il rischio di sviluppare linfoma intestinale e altre neoplasie gastroenteriche.
| Condizione associata | Tipo di relazione | Meccanismo principale | Impatto sul paziente | Note |
|---|---|---|---|---|
| Diabete mellito tipo 1 | Autoimmune associata | Predisposizione genetica (HLA) | Richiede monitoraggio congiunto | Screening consigliato nei celiaci |
| Tiroidite autoimmune | Autoimmune associata | Disregolazione immunitaria | Sintomi tiroidei variabili | Spesso coesiste con celiachia |
| Dermatite erpetiforme | Manifestazione cutanea | Reazione autoimmune alla gliadina | Prurito e lesioni cutanee | Diagnosi clinica e istologica |
| Anemia sideropenica | Complicanza nutrizionale | Malassorbimento del ferro | Affaticamento, pallore | Spesso primo segno di celiachia |
| Osteoporosi | Complicanza metabolica | Deficit di vitamina D e calcio | Fragilità ossea | Screening osseo consigliato |
| Neuropatia periferica | Manifestazione neurologica | Autoimmunità e carenze vitaminiche | Dolore, intorpidimento | Può migliorare con dieta gluten-free |
| Atassia | Manifestazione neurologica | Autoimmunità cerebellare | Problemi di coordinazione | Rara, richiede valutazione neurologica |
| Infertilità e aborti ricorrenti | Complicanza ostetrica | Malnutrizione e infiammazione | Difficoltà riproduttive | Screening in caso di infertilità |
| Linfoma intestinale | Complicanza neoplastica | Infiammazione cronica non controllata | Raro ma grave | Importanza della dieta priva di glutine |
Sintomi comuni e rari
I sintomi della celiachia possono variare da persona a persona e possono coinvolgere diverse parti del corpo. I sintomi gastrointestinali, come diarrea cronica, costipazione, dolore addominale, gonfiore e flatulenza, sono comuni. Inoltre, la malattia può causare perdita di peso non intenzionale e carenze nutrizionali a causa del malassorbimento dei nutrienti. Altri sintomi includono affaticamento cronico, debolezza, anemia da carenza di ferro, problemi dermatologici come rash cutanei, eczema, ulcere della bocca e perdita di capelli, disturbi neurologici come mal di testa, formicolio e difficoltà di concentrazione, problemi di fertilità e aumento del rischio di osteoporosi e fratture.
- Nella forma classica della malattia, i sintomi tipici includono diarrea, gonfiore addominale, dolori addominali, perdita di peso, malassorbimento intestinale e rallentamento della crescita nei bambini.
- Nella forma atipica, i sintomi possono manifestarsi in modi diversi, come affaticamento e stanchezza, perdita dei capelli, dimagrimento inspiegabile, ulcere e lesioni ricorrenti nella bocca, dolori addominali ricorrenti, vomito, aumento dei livelli di transaminasi nel sangue, disturbi del ciclo mestruale, ridotta statura, infertilità, poliabortività spontanea, disturbi della gravidanza, riduzione della massa ossea, formicolio e intorpidimento delle mani e dei piedi, mancanza di coordinazione muscolare.
- La forma silente è caratterizzata dalla assenza di sintomi evidenti ed è spesso diagnosticata durante programmi di screening. La forma potenziale si riferisce a individui che presentano esami sierologici positivi per gli anticorpi, ma una biopsia intestinale normale.
- Se non trattata adeguatamente, può portare allo sviluppo di altre malattie come la sprue collagenasica, la celiachia refrattaria, nonché linfomi e adenocarcinomi intestinali.
Le persone affette hanno anche una maggiore predisposizione a sviluppare malattie autoimmuni come la tiroidite autoimmune, il lupus eritematoso sistemico, il diabete di tipo 1, epatiti, vasculiti, artriti e la sindrome di Sjögren. Questa associazione potrebbe avere una base genetica.
I sintomi digestivi sono comuni e possono includere gonfiore addominale, dolori addominali, sensazione di pienezza, diarrea cronica, stitichezza, meteorismo e flatulenza, nausea, vomito, feci di colore chiaro sciolte e grasse con odore sgradevole e che galleggiano, perdita di peso e mal di stomaco.
È importante notare che può causare anche stitichezza, non solo diarrea, contrariamente a quanto comunemente si pensa.
Nei bambini affetti da celiachia, l’incapacità di assorbire adeguatamente i nutrienti può causare danni allo smalto dei denti permanenti, ritardo nella pubertà, cambiamenti di umore, irritabilità, impazienza, perdita di peso, ritardo nello sviluppo e statura inferiore alla media.
Negli adulti, i sintomi digestivi sono meno comuni e possono invece verificarsi anemia, lingua rossa, liscia e lucida, dolore osseo e/o articolare, dermatite erpetiforme, infertilità o aborti spontanei ripetuti, alterazioni del ciclo mestruale, disturbi della bocca, stanchezza severa e persistente, anomalie della coagulazione, riduzione del volume della milza, fragilità ossea come osteomalacia e osteoporosi.
I sintomi neurologici possono essere associati e includono cefalea, dolore neuropatico, parestesie, sindrome delle fascicolazioni benigne, confusione mentale, difficoltà di coordinazione muscolare, spasmi, irritabilità, depressione o ansia.
La diagnosi richiede esami specifici, come test del sangue per gli anticorpi e una biopsia dell’intestino tenue. È importante consultare un medico se si sospetta di avere la celiachia o se si manifestano sintomi correlati per una valutazione accurata e una diagnosi corretta.
La celiachia è una malattia autoimmune causata dall’ingestione di glutine in soggetti geneticamente predisposti. I sintomi possono essere vari e coinvolgere diversi sistemi del corpo. La diagnosi precoce e il trattamento adeguato sono fondamentali per prevenire conseguenze gravi e migliorare la qualità di vita dei pazienti celiaci.
| Categoria | Sintomi principali | Note | Fonte |
|---|---|---|---|
| Sintomi gastrointestinali | Dolore addominale, diarrea cronica o intermittente, stipsi, gonfiore, nausea, vomito, perdita di peso | Manifestazioni più frequenti nelle forme classiche | NHS.uk |
| Sintomi sistemici e generali | Affaticamento, anemia (da carenza di ferro o vitamine), perdita di appetito, febbre lieve | Conseguenza del malassorbimento e infiammazione sistemica | Mayo Clinic |
| Sintomi dermatologici | Dermatite erpetiforme (prurito intenso, rash cutaneo con vescicole) | Manifestazione cutanea tipica associata a celiachia | DermNetNZ |
| Sintomi neurologici | Atassia, neuropatia periferica, emicrania, depressione, ansia | Sintomi extraintestinali, probabilmente di origine autoimmune o metabolica | NINDS – NIH |
| Sintomi muscolo-scheletrici | Dolori articolari, osteopenia, osteoporosi | Legati al malassorbimento di calcio e vitamina D | NIH Osteoporosis and Related Bone Diseases |
| Sintomi orali | Stomatite aftosa, glossite, carie dentale | Frequenti nelle persone celiache, riflettono carenze nutrizionali | Journal of Oral Pathology & Medicine |
| Sintomi ginecologici/ostetrici | Amenorrea, infertilità, aborti ricorrenti | Associati a malnutrizione e infiammazione sistemica | ACOG |
| Sintomi psicologici | Ansia, depressione, difficoltà di concentrazione | Possibile effetto dell’infiammazione cronica e di carenze vitaminiche | PubMed Central |
La variabilità dei sintomi può dipendere da diversi fattori. La durata dell’allattamento materno può influenzare il momento in cui i sintomi si manifestano, poiché studi hanno dimostrato che più a lungo un neonato è stato allattato, più tardi i sintomi potrebbero comparire. Inoltre, la quantità di glutine consumato e l’età in cui è stato introdotto nella dieta possono influenzare la manifestazione dei sintomi. Le linee guida attuali suggeriscono di introdurre il glutine fin dall’inizio dello svezzamento, anche per i neonati prematuri, tenendo conto dell’età corretta.
La gravità dei danni intestinali e l’età del soggetto possono anche influenzare la variabilità dei sintomi. È importante notare che anche le persone asintomatiche, che non presentano sintomi evidenti, sono a rischio elevato di complicazioni se non viene trattata adeguatamente.
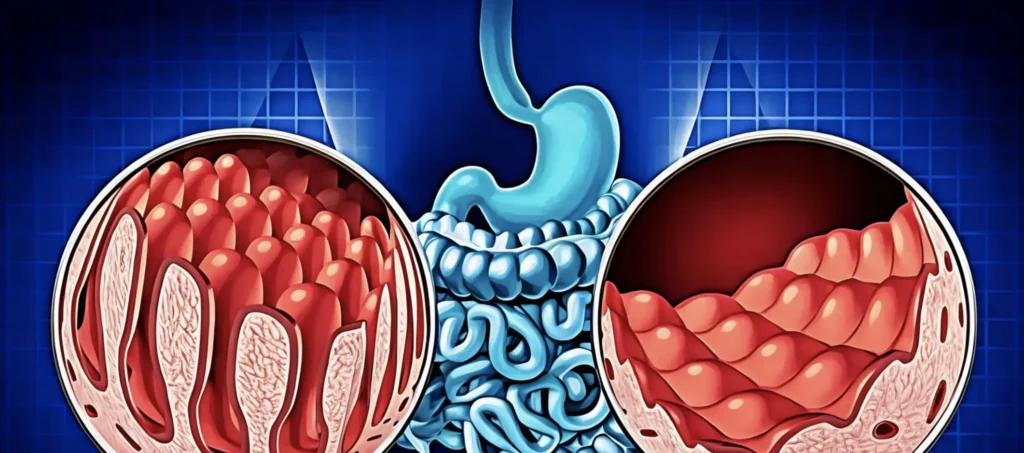
La dieta senza glutine rimane oggi il cardine del trattamento della celiachia, ma la continua evoluzione della ricerca offre nuove speranze. Vaccini inversi, terapie cellulari e farmaci molecolari mirati rappresentano una frontiera terapeutica in rapida espansione, destinata nei prossimi anni a modificare profondamente l’approccio alla gestione di questa condizione autoimmune
Diagnosi
La diagnosi della celiachia si fonda su un approccio multidisciplinare che combina dati clinici, esami di laboratorio, indagini strumentali e, in alcuni casi, analisi genetiche. Le linee guida internazionali indicano già un percorso diagnostico ben definito e delineato, che consente di identificare con precisione la malattia e di distinguere tra le diverse forme cliniche: classica, non classica, silente e potenziale.
Il processo diagnostico inizia con la valutazione clinica, basata sull’anamnesi e sull’esame obiettivo, prestando attenzione ai sintomi intestinali ed extraintestinali, nonché alla storia familiare o di altre malattie autoimmuni.
I test sierologici rappresentano il primo passo fondamentale per la diagnosi. Tra questi, gli anticorpi anti-transglutaminasi tissutale (anti-tTG IgA) sono i più utilizzati grazie alla loro elevata sensibilità e specificità. Gli anticorpi anti-endomisio (EMA IgA) vengono impiegati come test di conferma, mentre gli anticorpi anti-gliadina deamidati (DGP IgG/IgA) risultano utili soprattutto nei bambini piccoli o in presenza di deficit selettivo di IgA. È altresì importante misurare le IgA totali per escludere un deficit immunitario che potrebbe causare falsi negativi.
La biopsia intestinale, ottenuta tramite gastroscopia con prelievo bioptico della mucosa duodenale, costituisce il gold standard diagnostico, specialmente nei casi con sierologia positiva. L’analisi istologica valuta la presenza di atrofia villosa, iperplasia delle cripte e infiltrazione linfocitaria. In ambito pediatrico, recenti linee guida prevedono la possibilità di formulare la diagnosi senza biopsia, qualora siano soddisfatti criteri rigorosi come una sierologia altamente positiva, sintomi compatibili e positività degli anticorpi EMA.
L’analisi genetica degli alleli HLA-DQ2 e HLA-DQ8 è utile principalmente per escludere la celiachia, poiché la loro assenza rende la diagnosi molto improbabile; tuttavia, la presenza di tali alleli non è sufficiente da sola per confermare la malattia, in quanto molti portatori non sviluppano celiachia.
Infine, scale di valutazione e questionari, come il Celiac Symptom Index (CSI) e il Celiac Disease Quality of Life (CD-QOL), vengono impiegati per monitorare la gravità dei sintomi e la risposta alla dieta priva di glutine.
Per quanto riguarda le tipologie cliniche, la forma classica si manifesta con sintomi gastrointestinali evidenti e atrofia villosa. La forma non classica viene diagnosticata grazie a sintomi extraintestinali o aspecifici con danno intestinale documentato. La forma silente è caratterizzata dall’assenza di sintomi, ma con lesioni intestinali e positività sierologica. La celiachia potenziale si definisce per la presenza di positività sierologica e genetica senza evidenza di lesioni intestinali.
| Fase diagnostica | Strumenti/Esami | Scopo | Note per il paziente |
|---|---|---|---|
| Sospetto clinico | Anamnesi, esame fisico | Identificare segni e sintomi sospetti | Segnalare tutti i sintomi, anche quelli non intestinali |
| Test sierologici | Anti-tTG IgA, EMA IgA, Anti-DGP IgG/IgA, IgA totale | Screening e conferma iniziale | Richiede prelievo ematico; evitare dieta gluten-free prima del test |
| Biopsia intestinale | Gastroscopia con prelievo bioptico duodenale | Confermare danno intestinale | Esame invasivo, consigliato se sierologia positiva o dubbi diagnostici |
| Test genetici (HLA) | Ricerca HLA-DQ2/DQ8 | Escludere la diagnosi se negativi | Non diagnostico da solo; utile in casi complessi |
| Scale di valutazione | Questionari CSI, CD-QOL | Monitorare sintomi e qualità di vita | Utile durante il follow-up |
Cura
Attualmente, l’unico trattamento ufficialmente riconosciuto ed efficace per la celiachia consiste in una dieta strettamente priva di glutine, da mantenere per tutta la vita. Questo approccio permette la rigenerazione della mucosa intestinale nella maggior parte dei pazienti, con tempi di recupero che variano da pochi mesi nei bambini a diversi anni negli adulti.
Oltre alla dieta, sono in corso ricerche su diverse terapie aggiuntive, destinate a supportare o, in futuro, a integrare il trattamento:
- Enzimi digestivi (glutenasi): composti come la latiglutenasi, formata da due proteasi ricombinanti, aiutano a degradare i frammenti tossici del glutine ingeriti accidentalmente, riducendo l’infiammazione e i sintomi gastrointestinali.
- Inibitori della transglutaminasi 2 (TG2): il farmaco sperimentale ZED1227 ha dimostrato in studi clinici la capacità di limitare l’attivazione immunitaria a livello duodenale anche in presenza di glutine.
- Modulatori della permeabilità intestinale: il composto larazotide agisce sulle giunzioni strette della mucosa intestinale, diminuendo il passaggio dei peptidi del glutine e quindi l’attivazione della risposta autoimmune.
- Terapie per la celiachia refrattaria: nei casi in cui la malattia persiste nonostante la dieta (oltre 12 mesi), vengono utilizzati corticosteroidi, mesalamina, immunosoppressori (come l’azatioprina) e anticorpi monoclonali, in particolare Ordesekimab (anti-IL-15).
- Strategie sperimentali avanzate: sono in fase di studio vaccini a tolleranza immunitaria (vaccini inverse), cerotti transdermici (SOMIT), nanoterapie e nuove molecole immunomodulanti come Amlitelimab, TAK-101 e E40.
| Terapia | Descrizione breve | Indicazioni principali | Note utili per il paziente |
|---|---|---|---|
| Dieta gluten‑free (GFD) | Eliminazione completa del glutine da alimenti, farmaci e cosmetici | Prima linea, essenziale in tutti i pazienti | Rivedere etichette, evitare contaminazione, follow‑up con nutrizionista |
| Latiglutenasi (enzima) | Enzimi orali che degradano glutine residuo | Supporto in caso di ingestione accidentale | Non sostituisce GFD; possibile integrazione futura |
| ZED1227 (TG2 inhibitor) | Farmaco che blocca l’enzima TG2, prevenendo infiammazione duodenale | In sviluppo, come coadiuvante alla GFD | Disponibile solo nei trial; potrebbe ridurre i danni da glutine involontario |
| Larazotide (modulatore) | Riduce la permeabilità dell’intestino prevenendo l’entrata del glutine | Sperimentale, supporto alla GFD | Non sostituisce GFD; studi ancora in corso |
| Corticosteroidi/biologici | Prednisone, budesonide, Ordesekimab (anti‑IL‑15), mesalamina, azatioprina | Forme refrattarie dopo esclusione glutine accidentale | Utilizzati sotto rigida supervisione specialistica; sono farmaci onerosi |
| Terapie emergenti | Vaccini inverse, patch SOMIT, nanoimmunoterapia, enzimi di diverse aziende biotech | In fase preclinica o studi iniziali | Non ancora disponibili clinicamente |
Ricerca e prospettive per la celiachia
La ricerca scientifica sta attraversando una fase di notevole espansione, orientandosi verso approcci terapeutici innovativi che vadano oltre la semplice esclusione del glutine dalla dieta. Tra le prospettive più promettenti vi è lo sviluppo di terapie tollerogeniche, anche definite “vaccini inversi“. Questi trattamenti si basano sull’uso di nanoparticelle contenenti peptidi del glutine, progettate per “rieducare” il sistema immunitario a non attaccare il glutine. In studi clinici di fase II, l’assunzione controllata di glutine da parte di pazienti trattati non ha provocato danni alla mucosa intestinale, suggerendo un futuro potenziale impiego clinico entro 5–10 anni.
Un altro fronte in avanzata fase sperimentale è rappresentato dagli eTreg, ovvero linfociti T regolatori ingegnerizzati per riconoscere in modo specifico gli antigeni del glutine. In modelli animali, questi eTreg sono riusciti a sopprimere selettivamente la risposta autoimmune, aprendo la strada a una terapia cellulare altamente mirata. Attualmente, tale approccio è in fase preclinica, ma rappresenta un’evoluzione di grande interesse nel trattamento immunologico della celiachia.
Parallelamente, sono in sviluppo farmaci biologici e molecole piccole in grado di agire su diversi meccanismi patologici della malattia. Tra questi, il TPM502, una nanoparticella sviluppata da Topas Therapeutics, si propone di modulare la risposta infiammatoria. Un’altra molecola, IMU‑856, è progettata per favorire la rigenerazione della mucosa intestinale senza compromettere il sistema immunitario, attualmente in fase 2 di sperimentazione clinica. Infine, farmaci come ZED1227 (inibitore della transglutaminasi 2) e larazotide (modulatore della permeabilità intestinale) si trovano in fase avanzata di studio e puntano a limitare la reazione immunitaria e la penetrazione del glutine nella mucosa.
Queste terapie, sebbene non ancora disponibili per l’uso clinico diffuso, rivestiranno un’importanza cruciale per la gestione della malattia. Possono infatti ridurre il rischio legato alla contaminazione accidentale di glutine e offrire una risposta terapeutica in casi complessi, come nella celiachia refrattaria, che colpisce una percentuale variabile tra il 7% e il 30% dei pazienti, nonostante l’aderenza rigorosa alla dieta. Inoltre, possono contribuire a migliorare significativamente la qualità di vita, evitando l’impatto psicologico e sociale derivante da una dieta estremamente restrittiva.
| Obiettivo terapeutico | Approcci in fase avanzata | Stato della ricerca |
|---|---|---|
| Tolleranza immunitaria | Vaccini inversi (nanoparticelle), eTreg cellulari | Fase II / preclinica |
| Protezione mucosale | IMU‑856, TPM502 | Fase I/II |
| Barriera intestinale | Larazotide | Sperimentale avanzato |
| Inibizione enzimatica | ZED1227 (TG2 inhibitor) | Fase II |